Hongos simbiontes de hormigas cortadoras de hojas del género Acromyrmex en bosques secos del centro de Argentina
DOI:
https://doi.org/10.14522/darwiniana.2021.91.950Palabras clave:
Acromyrmex, Córdoba, gen 5.8S, ITS1, ITS2, LeucocoprinusResumen
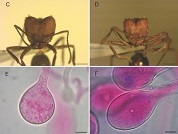
Los hongos asociados a hormigas cortadoras de hojas (HCH) juegan un rol fundamental en los ecosistemas Neotropicales. La asociación con hongos permite que las HCH sean los herbívoros dominantes en esta región, y de esta manera influyan activamente en los procesos ecológicos. A fin de conocer la diversidad taxonómica de simbiontes fúngicos asociados a HCH, se realizó un relevamiento en 10 sitios correspondientes al distrito Chaqueño Serrano dentro de la provincia Chaqueña y al distrito del Algarrobo dentro de la provincia del Espinal. Se recolectaron muestras de hongos cultivados por hormigas cortadoras de hojas, y una parte del material fúngico se cultivó en agar papa con dextrosa y otra se almacenó en buffer CTAB. Se realizaron amplificaciones de la región ITS1, ITS2 y gen 5.8S ribosomal. Con las secuencias se realizaron análisis filogenéticos (Máxima Verosimilitud y Bayesiano). Los resultados muestran que las hormigas cortadoras de hojas en las regiones muestreadas cultivan hongos simbiontes de dos clados (conocidos como A y B) bien diferenciados filogenéticamente. Los cultivos presentaron un crecimiento lento con desarrollo de estructuras globosas llamadas gongilidios, las cuales se agrupan formando estafilos (racimos). Entre las hormigas estudiadas, Acromyrmex striatus se asocia con hongos de ambos clados. En el Espinal (distrito del Algarrobo) se encontró a A. striatus asociada con hongos del clado B (Leucocoprinus sp.) y en el Chaco Serrano (distrito Chaqueño Serrano) a hongos del clado A (Leucocoprinus gongylophorus). Mientras que Acromyrmex crassispinus y A. heyeri incluidas en el estudio cultivan exclusivamente a L. gongylophorus del clado A independientemente de la región que habiten. Además, se reporta la primera identificación molecular del hongo L. gongylophorus cultivado por Acromyrmex silvestrii.
Descargas
Publicado
Cómo citar
Número
Sección
Licencia

A partir de 2012, esta obra está licenciada bajo una Licencia Creative Commons Atribución-NoComercial 2.5 Argentina .
Cualquier obra derivada deberá estar previamente autorizada con nota escrita de los editores.